Sonografie hrudníku v respirační medicíně
20. LUS v akutních protokolech urgentní a intenzivní medicíny
V případě urgentních a emergentních stavů není čas pro zevrubné a úplné vyšetření celého povrchu hrudníku. Využíváme zde skutečnosti, že se onemocnění způsobující tyto těžké a akutní stavy prezentují extenzivní lokalizací – těžký stav je dán právě rozsáhlým postižením plic. Proto se můžeme omezit na vyšetření několika málo bodů na povrchu hrudníku. Samozřejmě tímto snižujeme senzitivitu svého vyšetření. Níže uvedené protokoly zahrnující i vyšetření plic však byly v prostředí urgentní a intenzivní medicíny validovány a jsou dostatečným kompromisem mezi rychlostí a jednoduchostí provedení na jedné straně a senzitivitou vyšetření na straně druhé(1). Ukončením provedení protokolu však často vyšetřování nekončí. Pomocí LUS studujeme dále v akutních protokolech zjištěnou patologii, případně pátráme podrobnějším vyšetřením po patologii, která záchytu v protokolu unikla (např. protokol neukázal příčinu dušnosti, anamnéza a klinika je však vysoce suspektní na určitou diagnostickou jednotku – následuje rozšíření protokolů, viz dále).
Sonografie je proveditelná již v přednemocniční péči. LUS může jako jednodušší kolegyně echokardiografie přinést rychlé informace vedoucí k přesnější diagnostice příčiny dušnosti a změně managementu již v přednemocničním prostředí. Zanatta et al.(2) zkoumali přínos LUS právě u pacientů s těžkou dušností v přednemocniční péči a ukázali vysokou přesnost v odlišení dekompenzace srdečního selhání a COPD se změnou managementu pacientů u 42.3% případů. Již pouhé odlišení A-profilu od B-profilu ve ventrálních a dorzolaterálních partiích pomáhá v diagnostice a usměrňuje bezprostřední léčbu. Kombinací vyšetření a nálezů do protokolů (cíleně strukturovaných vyšetřovacích algoritmů) pak zvyšujeme senzitivitu a specificitu vlastního LUS vyšetření.
BLUE protokol
Cílová skupina pacientů
BLUE protokol (Bed-side Lung Ultrasound in Emergency) je protokolem pro vyšetření pacienta s akutní těžkou dušností přicházejícího z mimonemocničního prostředí(1). Jedná se tedy typicky o vyšetření na vysokém prahu urgentního příjmu (,,emergency room,,) či přímo posádkou ZZS v terénu a to pacienta s relativně rychle vzniklou dušností a poruchou oxygenace (BLUE jako modrý, cyanotický pacient). Není to protokol pro vyšetření pro pacienta s chronickou postupně se exacerbující dušností ani náhle těžce dušného pacienta nacházejícího se již v nemocniční péči (na standardním oddělení, a už vůbec ne ležícího delší dobu na ICU). Konstrukce protokolu vychází z předtestové pravděpodobnosti přítomnosti příčin těžké dušnosti u běžné komunitní, ne nemocniční populace. Proto by např. nebyl závěr neprokazující plicní embolii jako příčinu akutní těžké dušnosti u již hospitalizovaného pacienta nedostatečně senzitivní a nemohl tuto dg. na základě BLUE protokolu s dostatečnou pravděpodobností vyloučit. Nutno opět upozornit, že ukončením BLUE protokolu diagnostika nekončí, ale často dále podrobněji zkoumáme zjištěný nález, dále jej diferencujeme či ověřujeme (tzv. extended BLUE protokol). Jakmile nám pak v našem diagnostickém procesu něco nesedí, je často třeba vrátit se na začátek a celé naše počínání kriticky přehodnotit.
BLUE protokol sklidil kritiku, že je nedostatečně senzitivní pro kardiální dekompenzaci jako příčinu dušnosti(3). Kritika prokázala, že iniciální vynechání vyšetření laterálních partií hrudníku, a tedy spoléhání na BLUE body ventrálně snižuje senzitivitu vyšetření. Sforza et al. přišli k podobnému zjištění, ovšem se správným konstatováním, že se zvyšující se tíží dušnosti se přidaná hodnota vyšetření hrudníku laterálně snižuje (4). Zcela však to odpovídá původnímu konceptu BLUE protokolu, a to jeho indikaci pouze pro pacienty s akutní a těžkou dušností. Jinde nemusí fungovat dostatečně spolehlivě, jako např. v případě mírné či středně těžké dušnosti u pacientů, kde kongesce nezasahuje zcela ventrálně.
Absence ventrálního nálezu IS s objevením se až laterálně s dominancí bazálně u dušného pacienta může být dáno např. hyperinflací ventrálních partií plic při komorbiditě pacienta (COPD). Pokud má takovýto pacient nález IS pouze laterálně a dorzálně a projde BLUE protokolem, skončíme vyšetření v PLAPS bodech, a to právě s bilaterálním nálezem IS různého stupně, s eventuální přítomností výpotku a konsolidací bez známek typických pro pneumonii (např. při kompresivní atelektázy). Pacientovi však nebude přidělena diagnóza oboustranná bazální pneumonie. Využíváme tzv. rozšířený BLUE protokol. Do BLUE protokolu implementujeme i anamnestická data, laboratoř, další informace z pomocných vyšetření a kliniku. Je to protokol pro použití lékařem. Čistý BLUE protokol je pouze jistý rigidní návod pro vyšetření specificky nemocného pacienta, který samozřejmě jako všude v medicíně nelze plně a vždy bez chyb použít.
V případě suspekce na kardiální etiologii dušnosti u pacienta nesplňujícího kritéria vstupu do BLUE protokolu tedy hodnotíme plicní povrch pomocí rozsáhlejšího vyšetření (viz LUS skóre, B-line skóre a jejich modifikace). Vyšetřujeme minimálně v 6 (oboustranně horní, dolní a PLAPS bod) nebo 8 bodech (přidáme oboustranně ještě vyšetření o několik mezižebří kraniálně od PLAPS bodu). Zjednodušeně můžeme jako nález potvrzující suspekci na kongesci kardiální etiologie vzít pozitivní nález IS v jednom z vyšetřovaných bodů oboustranně(5), případně pouze nález IS v tzv. wetspots (3.mezižebří v přední a střední axilární čáře, viz kapitola 9).
Vlastní provedení BLUE protokolu
Vyšetření začíná vyšetřením horního a dolního BLUE bodu oboustranně. Hodnotíme přítomnost nebo absenci lung slidingu. Při jeho jednostranné absenci se zajímáme, zda vidíme v Merlinově prostoru postižené strany reverberační artefakty či IS. Při nálezu reverberací a absenci plicního pulzu myslíme na PNO a hledáme laterálně lung point. Při jednostranném nálezu B´-profilu, B-profilu či C-profilu myslíme na rozsáhlou jednostrannou pneumonii. Oboustranný B-profil v minimálně jednom ze dvou BLUE bodů na každé straně indikuje plicní otok jako příčinu akutní těžké dušnosti. V případě normálního nálezu v BLUE bodech (A-profil) následuje žilní vyšetření. Toto je kamenem úrazu celého BLUE protokolu. V tomto kroku je našim úkolem snažit se detekovat trombózu. Při jejím nálezu uzavíráme protokol s diagnózou plicní embolizace. Pokud trombózu neprokážeme, pokračuje BLUE protokol vyšetřením hrudníku v PLAPS bodech oboustranně, kde hledáme známky konsolidace či výpotku jako známek svědčících opět pro pneumonii.
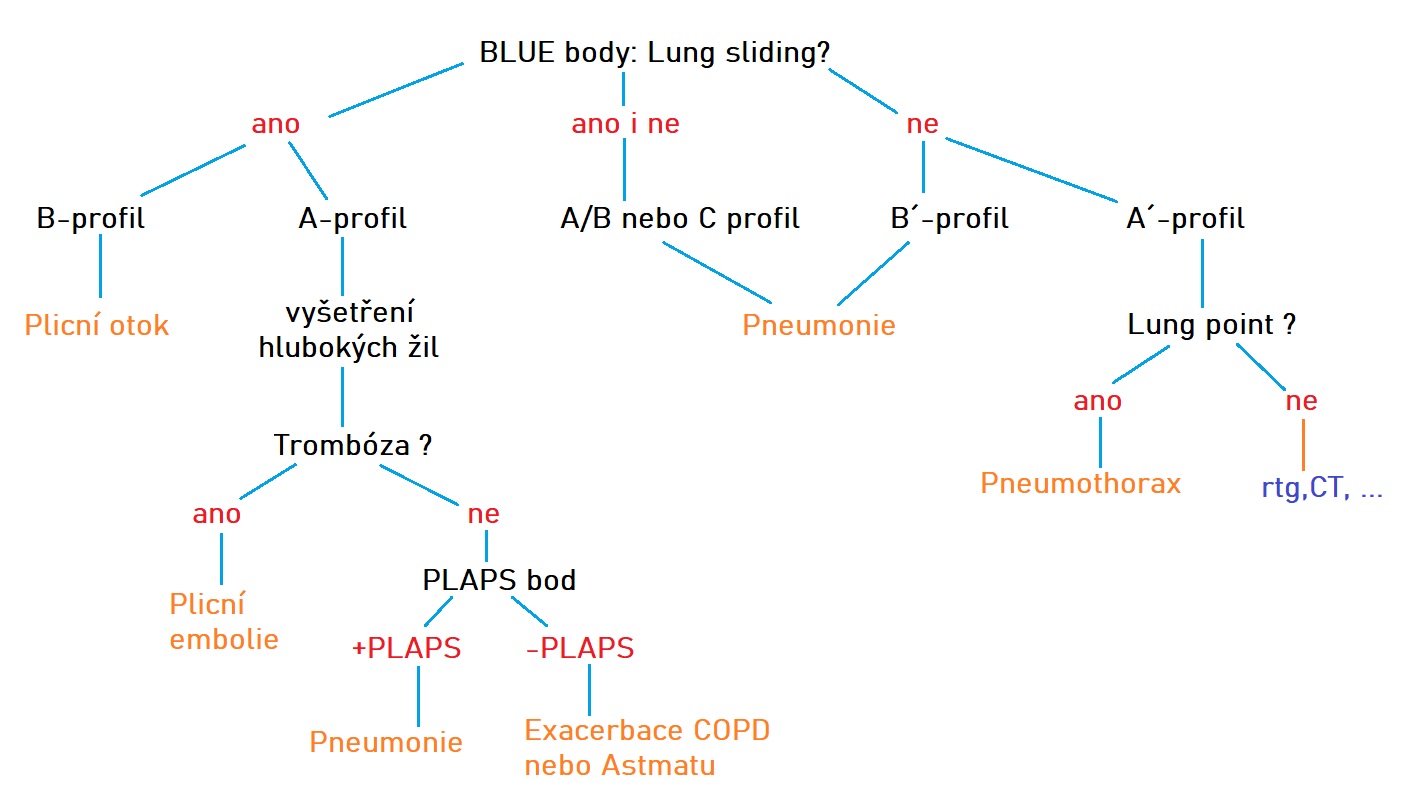
Obr.: BLUE protokol, převzato z (6).
A/B profil = A-profil na jedné straně a B-profil na druhé straně hrudníku.
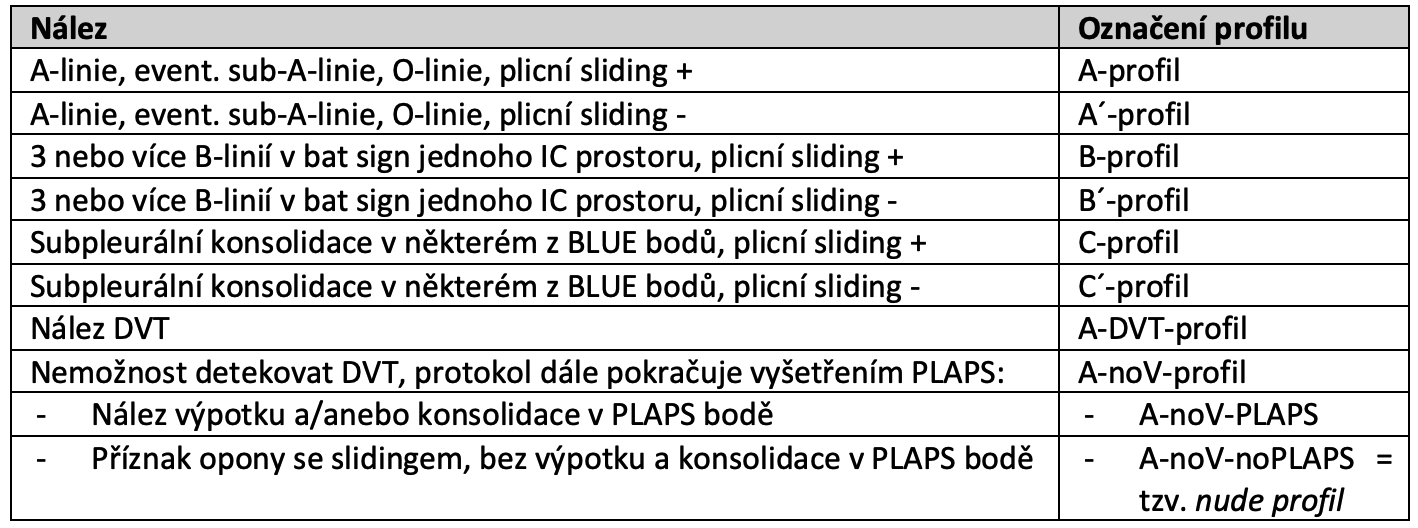
Tab.: Nálezy během BLUE protokolu.
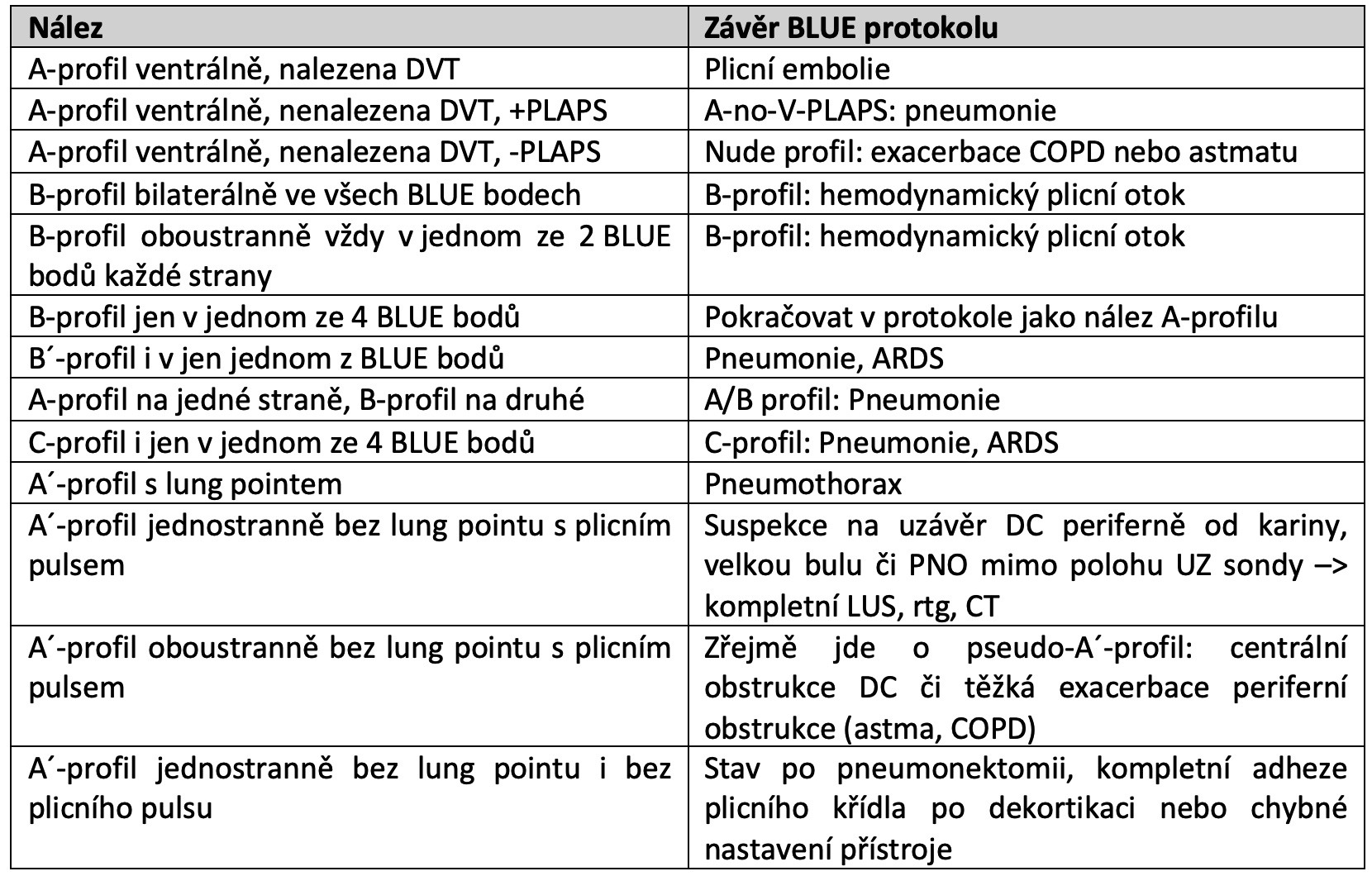
Tab.: Závěry BLUE protokolu.
Při normálním nálezu v PLAPS bodech (tzv. nude profile) jsme nenašli žádnou patologii na plicích ani v žilním řečišti. Protokol končí se suspekcí na onemocnění DC jako příčiny akutní těžké dušnosti (dekompenzace astmatu nebo COPD). Zde je čas na zamyšlení. Sedí anamnéza a fyzikální nález na tento závěr BLUE protokolu? Nemáme se přece jen ještě vrátit k žilní analýze a snažit se vyšetřit zapomenuté nebo špatně zobrazitelné žilní lokality? Nebyla při vyšetření v BLUE či PLAPS bodech přítomná stranová asymetrie v rozsahu plicního slidingu, která by nás upozornila na jednostrannou významnou poruchu ventilace?
BLUE protokol je multiorgánový POCUS protokol, který je vnímán jako jednoduchý. Jeho největší slabinou je však zřejmě žilní analýza, která může být při limitovaném žilním vyšetření nedostatečně senzitivní. V případě suspekce na PE nelze podrobně nevyšetřit lýtkové žíly a to oboustranně. Mysleme proto vždy na předtestovou pravděpodobnost přítomnosti DVT a PE u konkrétního pacienta a nedržme se vždy rigidně tohoto protokolu. V případě suspekce doplňme okamžité vyšetření srdce na akutní pravostranné přetížení, podívejme se ještě jednou a lépe na hluboké žíly a mysleme také na možnosti CEUS v diagnostice plicních infarktů (viz kapitola 22).
Diagnostická přesnost BLUE protokolu je jeho autorem udávána 90.5%. Je několik dalších jednotek, které mohou vyvolat akutní těžkou dušnost a které mohou BLUE protokolu uniknout popř. je protokol přiřadí k nesprávné etiologii potíží. U exacerbace chronického intersticiálního onemocnění můžeme v BLUE-protokolu nesprávně určit jako příčinu levostranné srdeční selhání či pneumonii. Masivní pleurální výpotek skončí v BLUE-protokolu také jako dg. pneumonie. Paréza bránice, uzávěry velkých DC či stenózy trachey skončí jednostranným A´-profilem bez nálezu lung pointu nebo nude profilem.
Zásadní význam má BLUE protokol pro diagnostiku život ohrožujících stavů spojených s dušností:
- Pneumothorax
- Hemodynamický plicní otok, včetně detekce astma cardiale a jeho odlišení od prosté dekompenzace COPD
- Detekce známek svědčících pro rozsáhlé zánětlivé postižení plic až ARDS
- Detekce hluboké žilní trombózy při normálním ventrálním nálezu na plicích je v případě urgentního až emergentního stavu u pacienta s dostatečnou předtestovou pravděpodobností vysoce suspektní na masivní plicní embolizaci
- Normální nález na LUS vede k suspekci na onemocnění DC, avšak při absenci klinických známek (spasticita, tichý hrudník, stridor, zapadávání jugula a mezižebří, …) pak nadále zůstává vysoká suspekce na PE
Diagnostická přesnost dokonale provedeného BLUE protokolu pro jednotlivé patologie je různá. Vynikající jsou NPV pro vyloučení hemodynamického plicního otoku, plicní embolie či pneumothoraxu. Senzitivity pro dg. plicní embolie stejně jako jednotlivých nálezů svědčících pro pneumonii jsou však nízké:
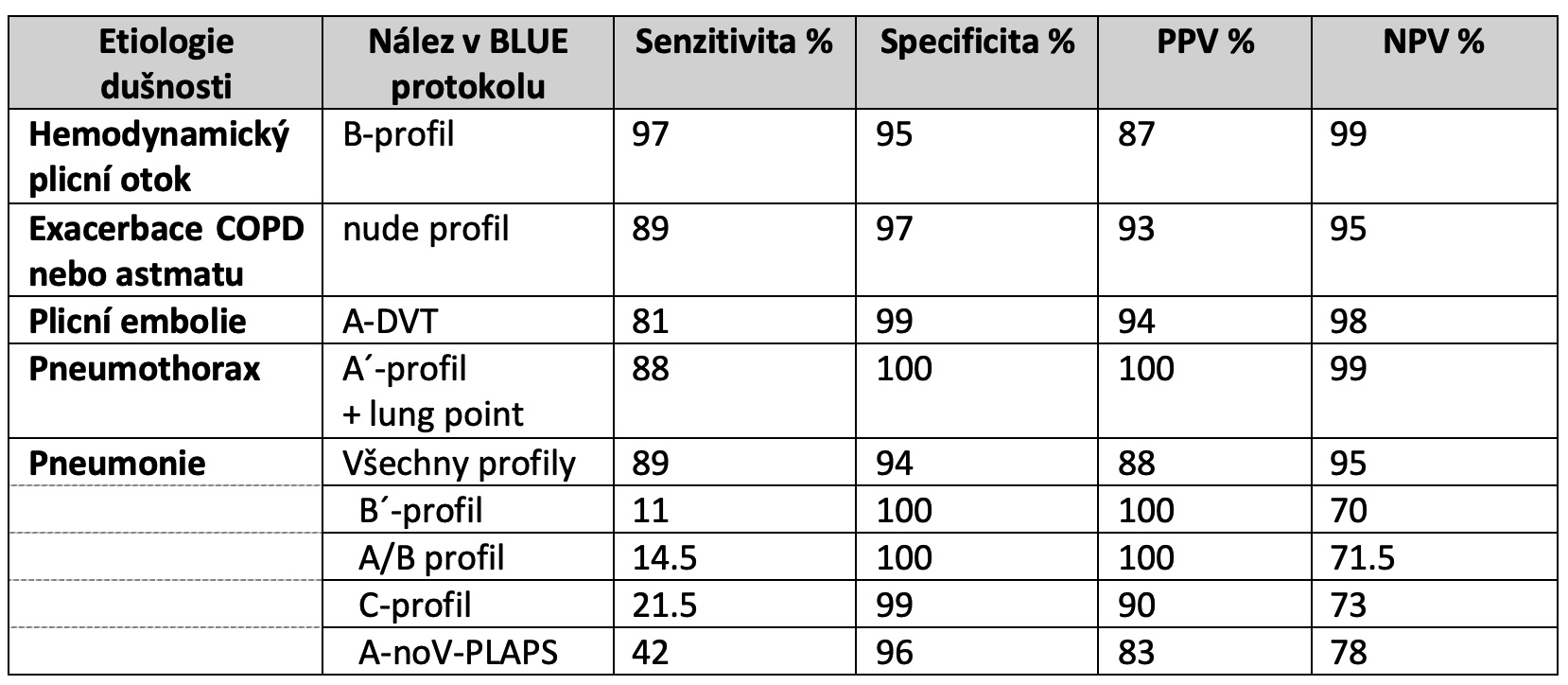
Tab.: Diagnostická přesnost BLUE protokolu pro jednotlivé etiologie akutní těžké dušnosti, převzato z (7).

Tab.: Senzitivita a specificita BLUE protokolu dle metaanalýzy z roku 2022 (11).
eFAST protokol
Součástí FAST protokolu (Focused Assessment with Sonography in Trauma) může být i rozšířený pohled na pleurální dutiny (eFAST, extended FAST). Při vyšetření podbráničních prostor v rámci FAST protokolu se proto současně díváme i do dorzálních partií pleurálních dutin a pátráme po přítomnosti i minimálního pleurálního výpotku. Na pravé straně můžeme využít pohled přes játra při přiložení sondy v medioklavikulární či přední axilární čáře směřováním UZ řezu přes játra do nejdorzálnější části baze pravé pohrudniční dutiny, na levé straně se můžeme ze střední axilární čáry pokusit prohlédnout přes slezinu a bránici co nejvíce dorzálně do baze levé pohrudniční dutiny, popř. pak musíme posunout sondu co nejdorzálněji a dívat se přímo na kostofrenický úhel a hledat volnou tekutinu v pleurálním prostoru přímo ,,pod sondou,,. Dále se pak díváme oboustranně ventrálně (u traumatizovaného pacienta ležícího naznak preferenčně v obou dolních BLUE bodech) na přítomnost lung slidingu, při jeho absenci zjišťujeme příčinu (suspekce na pneumothorax, viz kapitola 10).
FALLS protokol
Fluid Administration Limited by Lung Sonography (FALLS) protokol je protokolem prof. Lichtensteina k diferenciální diagnostice šokového stavu. Pomocí sledování aerace plic a jejich změn během podávání tekutinové terapie může pomoci v situacích, kdy máme před sebou pacienta v šokovém stavu neznámé etiologie a nejsme schopni vyšetřit echokardiograficky levé srdce. Pohled na pravou komoru a následně plicní parenchym nám pomůže v rychlé diferenciální diagnostice obstrukčního a kardiogenního šoku, kde zahájíme specifickou terapii. Pokud tyto druhy šoku nenalézáme, podáváme pacientovi objemovou výzvu. V případě hypovolemického šoku tímto současně léčíme. V případě septického šoku nám může FALLS protokol pomoci v odhadu, kdy již ukončit tekutinovou terapii. Protokol zatím t.č. nebyl validován a jedná se o patofyziologickou úvahu. První větší prospektivní randomizovaná studie sledující vliv FALLS protokolu u septických pacientů (qSOFA skóre ≥2) na jejich outcome byla zahájena v roce 2021 (8).
Problémem FALLS protokolu jsou dvě fakta. FALLS protokol nezohledňuje případnou dilataci pravé komory vzniklou až během podávání tekutinové terapie. Objemové přetížení pravého srdce však může vést posunem mezikomorového septa k omezení plnění levé komory a zhoršení šokového stavu (např. septického). Druhým problémem je limit pro podávání tekutin a tím je ve FALLS protokolu objevení se IS, tedy již vyjádřené plicní kongesce. Ve světle dnešního pohledu na škodlivost hyperhydratace tedy nelze v současné klinické praxi navržený FALLS protokol bez jasné validace bezpečně používat.
Použití FALLS protokolu vidím v rezervovaných situacích pro prvotní rozhodnutí v diferenciální diagnostice šokového stavu a jeho bezprostřední léčbě (obstrukce vs. kardiogenní selhání vs. suspektní hypovolemie se zcela odlišnými terapeutickými postupy). Po diskuzích s jeho autorem navrhuji pro tyto stavy modifikaci originálního FALLS protokolu zohledňující opakovaně stav pravého srdce:
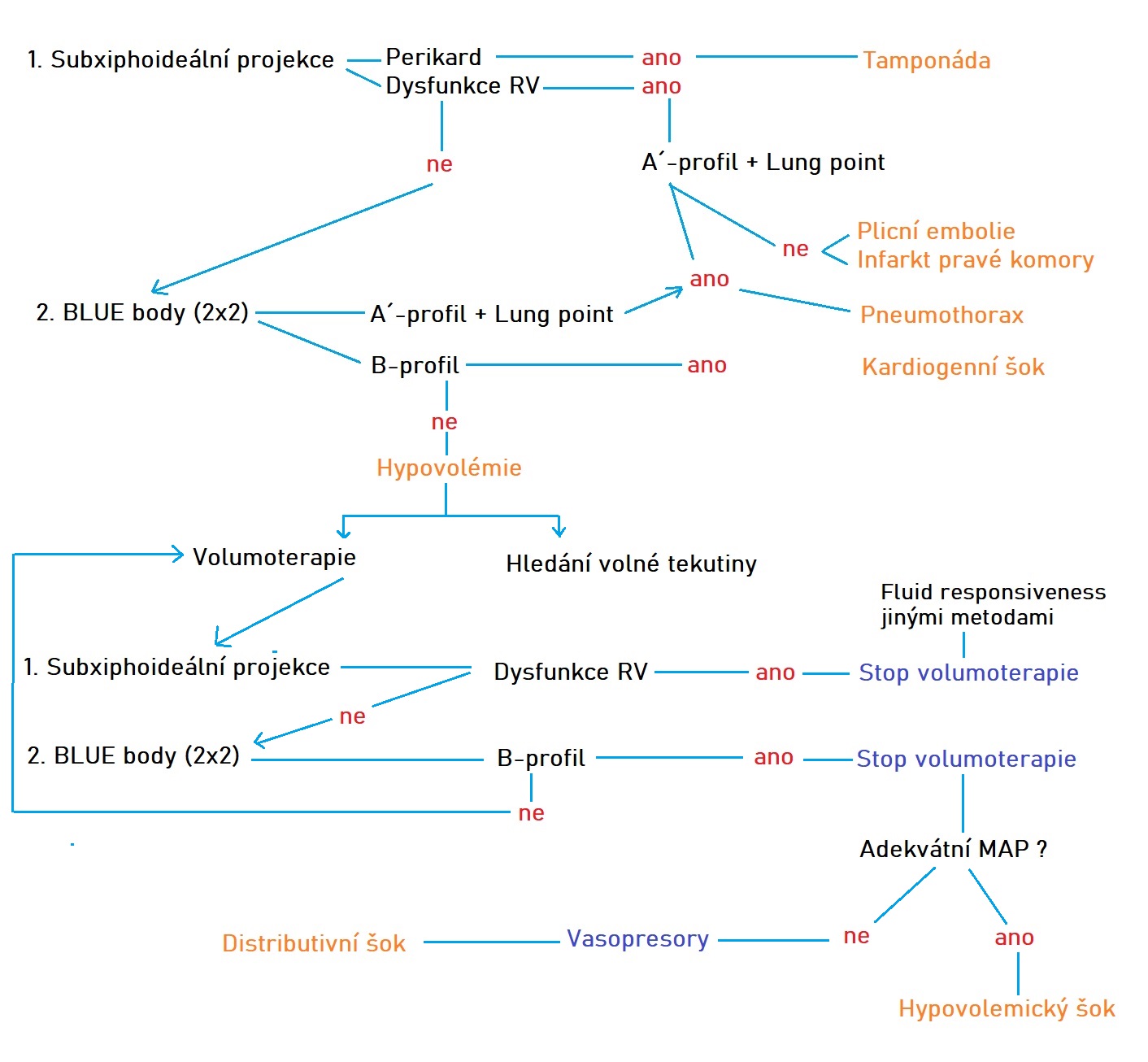
Obr.: Modifikovaný FALLS protokol.
Vyšetření začíná subxiphoideálním pohledem na pravé srdce k vyloučení obstruktivní etiologie šoku (srdeční tamponáda, dilatace RV jako známka suspektní z masivní plicní embolizace). V případě absence známek obstrukce následuje analýza horního ev. dolního BLUE bodu a hledáme známky plicního otoku či PNO. Protokol pokračuje v případě normálního nálezu, v tuto chvíli nám zůstává v rozvaze hypovolemický a distributivní šok. Oba v tento okamžik začínáme léčit podáním tekutin. Během jejich infuze analyzujeme obvyklé prostory či další klinicky suspektní lokality na event. přítomnost krvácení jako příčiny hypovolemii. Po úvodním bolusovém podání tekutin provádíme opět analýzy pravého srdce (dilatace RV ?) a ventrálního povrchu plic (změna A-profilu v B-profil a tedy počínající kongesce). Dilatace RV či objevení se B-profilu ventrálně jsou stopkou dalšímu podávání tekutin, případnou trvající hypotenzi korigujeme nasazením nebo úpravou dávky vasopresoru.
RUSH protokol
RUSH (Rapid UltraSound in Shock) protokol vyšetřuje šokové pacienty pohledem na 3 kompartementy oběhového systému a zkoumá jejich náplň, těsnost a výkon pumpy:
- zásobník krve (obsah VCI, ev. krev v třetím prostoru)
- pumpa (srdce – pravá a levá komora a perikard) a
- trubky (aorta, DVT)
TUS obsahuje při pátrání po volné tekutině v hrudní dutině, k vyšetření připojuje i ventrální pohledy k vyloučení pneumothoraxu. Na internetu je k dohledání mnoho grafických návodů s různým pořadím vyšetřování jednotlivých struktur.
SESAME protokol
SESAME (Sequential Emergency Sonography Assessing MEchanism or origin of severe shock of indistinct cause) je protokol popisován prof. Lichtensteinem pro periresuscitační použití u pacientů se srdeční zástavou nebo těžkým šokovým stavem. Jeho cílem je identifikovat některé z 4H/4T příčin, je určen pro pacienty s nedefibrilovatelným srdečním rytmem na EKG. Může nahradit vyšetření v terénu v případě, že není možno získat akustické okno pro pohled na srdce. V prvním kroku vylučujeme pneumothorax a hemodynamický plicní otok, druhým krokem je zahájení volumoterapie a současně jednobodové vyšetření nad kolenem k detekci trombózy (a tím vysoké suspekci na plicní embolizaci jako příčiny srdeční zástavy). V případě, že nenajdeme DVT, následuje hledání volné tekutiny v břišní dutině a až poté ev. další pokus o pohled na perikard a srdce.
Diagnostická přesnost LUS u traumat hrudníku
LUS je ve své omezené formě součástí eFAST protokolu, jehož cílem je detekce tekutiny či vzduchu v pohrudničních dutinách. V této souvislosti je nutno být si vědom limitací LUS při vyšetření pacienta přednemocničně nebo na urgentním příjmu. Takovýto pacient je typicky v supinní poloze fixován k pevné podložce a sonografický přístup je omezen na vyšetření ventrálních, laterálních a částečně omezeně dorzálních partií pohrudničních dutin. V případě pneumothoraxu nám toto nevadí a senzitivita i specificita vyšetření pro detekci klinicky významného nálezu je dostatečná(9). V případě snahy o detekci volné tekutiny (hemothorax) a plicní kontuze jsme však omezení. Pro dosažení maximální senzitivity pro detekci tekutiny se pak snažíme využít akustická okna jater a sleziny a UZ paprsek směřovat přes tyto orgány do nejdorzálnějších částí bazí pohrudničních dutin. I tak se pohybují senzitivity pro hemothorax a kontuzi okolo 45 resp. 58 %, specificita vyšetření pak dosahuje 100 % v obou případech(10). Opakovaná vyšetření s časovým odstupem či CT vyšetření jsou proto pro zvýšení senzitivity nutné. Dodatečné potíže může LUS působit také přítomnost subkutánního emfyzému, který není u traumat žádnou vzácností.
Reference
- Lichtenstein DA, Mezière GA. Relevance of lung ultrasound in the diagnosis of acute respiratory failure the BLUE protocol. Chest. 2008;
- Zanatta M, Benato P, De Battisti S, Pirozzi C, Ippolito R, Cianci V. Pre-hospital lung ultrasound for cardiac heart failure and COPD: is it worthwhile? Critical Ultrasound Journal. 2018;10(1):1–7.
- Volpicelli G, Noble VE, Liteplo A, Cardinale L. Decreased sensitivity of lung ultrasound limited to the anterior chest in emergency department diagnosis of cardiogenic pulmonary edema: A retrospective analysis. Critical Ultrasound Journal. 2010;2(2):47–52.
- Sforza A, Carlino MV, Guarino M, Romano G, Paladino F, de Simone G, et al. Anterior vs lateral symmetric interstitial syndrome in the diagnosis of acute heart failure. International Journal of Cardiology. 2019 Apr 1;280:130–2.
- Buessler A, Chouihed T, Duarte K, Bassand A, Huot-marchand M, Gottwalles Y, et al. Accuracy of Several Lung Ultrasound Methods for the Diagnosis of Acute Heart Failure in the ED. CHEST. 2019;(August).
- Lichtenstein DA. Whole body ultrasonography in the critically Ill. Whole Body Ultrasonography in the Critically Ill. Springer Verlag; 2010.
- Lichtenstein D. Novel approaches to ultrasonography of the lung and pleural space: Where are we now? Breathe. 2017;13(2):100–11.
- Alharthy A, Faqihi F, Abuhamdah M, Noor A, Naseem N, Balhamar A, et al. Prospective Longitudinal Evaluation of Point-of-Care Lung Ultrasound in Critically Ill Patients With Severe COVID-19 Pneumonia. Journal of Ultrasound in Medicine. 2021 Mar 1;40(3):443–56.
- Helland G, Gaspari R, Licciardo S, Sanseverino A, Torres U, Emhoff T, et al. Comparison of Four Views to Single-view Ultrasound Protocols to Identify Clinically Significant Pneumothorax. Academic Emergency Medicine. 2016 Oct 1;23(10):1170–5.
- Jahanshir A, Moghari SM, Ahmadi A, Moghadam PZ, Bahreini M. Value of point-of-care ultrasonography compared with computed tomography scan in detecting potential life-threatening conditions in blunt chest trauma patients. Ultrasound Journal. 2020;12(1):6–15.
- Dimas Asmara O, Wicaksono Pitoyo C, Wulani V, Harimurti K, Araminta AP. Accuracy of Bedside Lung Ultrasound in Emergency (BLUE) Protocol to Diagnose the Cause of Acute Respiratory Distress Syndrome (ARDS): A Meta-Analysis. Vol. 54, Acta Med Indones-Indones J Intern Med •. 2022.
Poslední aktualizace dne 20.01.2023
