Sonografie hrudníku v respirační medicíně
22. Role sonografie v diagnostice a léčbě plicní embolie
,,Pacient s podezřením na plicní embolii,, – co si pod tímto pojmem představujeme? Je to pacient, který přichází s náhle vzniklou těžkou dušností, pacient s několika dny trvající mírnou dušností, nevýkonností a tachykardií nebo jen pacient, který přichází pro celkové zhoršení stavu a byly u něj naordinovány v rámci panelu vyšetření D-dimery, které vyšly pozitivní? Pokud jsme již diagnostikovali plicní embolii (PE) či ,,jen,, hlubokou žilní trombózu (DVT), máme je léčit? A pokud ano, jak dlouho? Máme kontrolovat efekt antikoagulační léčby a pokud ano, jak? Na mnoho těchto otázek budeme hledat odpovědi v následující kapitole.
Známky a příznaky PE
Mnoho pacientů je bezpříznakových (až 45 %)(1). Mezi klasické příznaky PE patří klidová či pouze námahová dušnost, ortopnoe, tachypnoe, bolest na hrudi, synkopa, hemoptýza, tachykardie, hypoxémie, známky elevace žilního tlaku (distenze krčních žil) či náhlá srdeční zástava(2). Nástup dušnosti je ve většině (72%) případů popisován jako náhlý (v řádu sekund až minut), může se však pohybovat i v řádu dnů. U starších pacientů jsou příznaky často méně vyjádřeny(3). Soubor příznaků je často nespecifický a v nepřítomnosti klinických známek DVT pak můžeme ve své diferenciálně diagnostické rozvaze na PE úplně zapomenout.
Zhodnocení předtestové pravděpodobnosti přítomnosti PE
Každému diagnostickému postupu by měl předcházet proces klinického zhodnocení předtestové pravděpodobnosti přítomnosti PE u daného pacienta (pre-test probability). Správnou indikací dalších vyšetření dle tohoto rizika zvyšujeme jejich senzitivitu a specificitu, současně snižujeme počet falešně pozitivních i negativních výsledků s jejich možnými negativními konsekvencemi. Nelze postupovat paušálně u každého pacienta stejně a interpretovat výsledky vyšetření bez ohlédnutí se na vstupní odhad tohoto předtestového rizika. Cesta vyšetřování pacientů paušálním panelem vyšetření vede k nadužívání invazivních a drahých metod se všemi negativními dopady jak na pacienta, tak na zdravotní systém.
Proto je důležité identifikovat na začátku procesu rizikové faktory pro PE u konkrétního pacienta. Rizikové faktory (RF) pro PE jsou identické s těmi pro DVT. Rizikové faktory dělíme na vrozené a získané.
Mezi vrozené řadíme genetické faktory (Leidenská mutace apod.), získané RF poté dělíme na provokované a neprovokované(4):
Provokované RF (tučně zvýrazněny nejsilnější RF):
- Imobilizace (klid na lůžku v posledních 3 měsících po dobu minimálně 3 po sobě následujících dnů)
- Recentní chirurgický zákrok či trauma
- Hormonální léčba (estrogeny, testosteron, kortikoidy)
- Aktivní onkologické onemocnění
- Předchozí DVT či PE
- Těhotenství
- Získané prokoagulační stavy (nefrotický syndrom, chronická renální insuficience, antifosfolipidové protilátky, jaterní onemocnění, HIT, hyperviskózní sy.)
- Srdeční selhání
Neprovokované RF
- Obezita
- Těžké kuřáctví
- Anatomické abnormity (např. May-Turnerův sy.(5))
Se zhodnocením hlavních rizikových faktorů nám pomáhá jedno z validovaných skóre, např. Wellsovo či Ženevské, popřípadě jejich modifikované verze (viz tabulky níže)(6). Použitím těchto skóre dostaneme k dispozici jednu z tzv. předtestových pravděpodobností, tedy pravděpodobnost, zda pacient skutečně trpí PE: nízkou, střední a vysokou. Modifikovaná Wellsova kritéria(7) poté používají stejné bodování RF, ale s dichotomním závěrem: PE pravděpodobná/nepravděpodobná. Při použití těchto skóre však buďme nadále lékaři a nezapomínejme na širší pohled na pacienta (např. předtestové skóre indikující nízkou pravděpodobnost PE u pacienta s nefrotickým syndromem, antifosfolipidovými protilátkami(8) či recentně prodělaným COVID-19). Z vyhodnoceného stupně předtestového rizika poté vychází odlišné diagnostické postupy pro konkrétní situaci. Dokumentace zhodnocení předtestového rizika by měla být nedílnou součástí každého hemodynamicky stabilního pacienta se zahrnutím PE do diferenciálně diagnostické rozvahy.
Pro kalkulaci lze využít webové kalkulátory (např. www.mdcalc.com).

Tab.: Modifikovaná Wellsova kritéria.
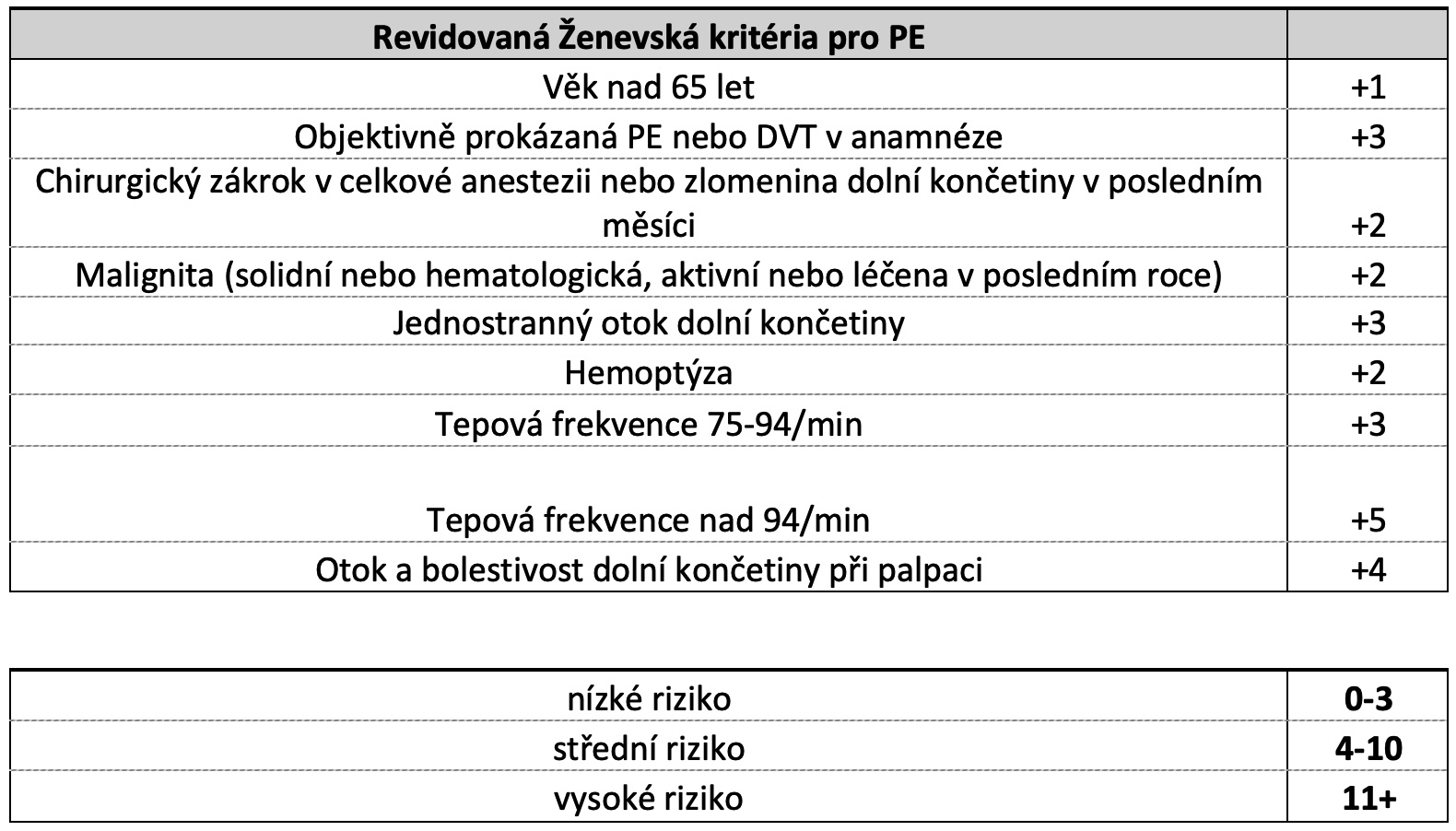 Tab.: Revidovaná Ženevská kritéria.
Tab.: Revidovaná Ženevská kritéria.
Dostupné metody v diagnostice PE
Pro diagnostiku PE musíme pochopit její patofyziologii, kterou určuje jak zdroj embolu, jeho dráha do plicního řečiště, tak také uzávěr části plicního řečiště s dopadem jak na povodí za embolem (plicní parenchym), tak na povodí před embolem (pravá polovina srdce). V sonografické diagnostice se tedy můžeme opřít o průkaz zdroje embolizace (sonografie žil), přímý průkaz embolu či jeho dopadu na pravé srdce (echokardiografie) a plicní parenchym (LUS).
V diagnostice PE pomocí CT angiografie plicnice (CTPA) pak prokazujeme přímo embolus v plicním řečišti, nepřímé známky plicní hypertenze jako jsou dilatace arteria pulmonalis(9) či pravého srdce(10) nebo změny perfuze a morfologie periferního plicního parenchymu (hypoperfuze, plicní infarkty)(11). Dle CTPA lze demonstrovat i hemodynamický dopad PE(12). Standardem je multidetektorové CT (MDCT) s možností lokalizace embolů do subsegmentální úrovně(13). Novější generace přístrojů a možnosti postprocesingu a analýzy získaných dat umožňují snížení radiační dávky i dávky kontrastní látky za současného zlepšení diagnostické přesnosti(14). Předností metody je také detekce alternativních diagnóz jak plicních, tak mimoplicních (např. tzv. triple-rule-out CT u bolestí na hrudi(15)). Je důležité si však uvědomit, že tato metoda nemá 100 % senzitivitu. Ta může být zvýšena použitím tzv. CT s dvojí energií (dual-energy CT)(16) ev. včetně perfuzního zobrazení(17). Stejně tak může CTPA poskytnout falešně pozitivní nálezy(18) (s event. negativními konsekvencemi pro pacienta). Nález CTPA pak dáváme vždy do souvislosti s předtestovou pravděpodobností PE (např. negativní CTPA u pacienta s vysokou předtestovou pravděpodobností pro PE by neměla vést automaticky k vyloučení diagnózy PE).
K dalším zobrazovacím diagnostickým metodám patří scintigrafie (ventilačně/perfuzní , V/Q sken), MRA (MR angiografie) či klasická venografie, popř. magnetická resonance (MRI) plic. V/Q sken můžeme provádět v klasické planární formě nebo jako SPECT vyšetření. Výhodou obou metod je nižší radiační zátěž v porovnání s CTPA, nevýhodou pak především velké množství nediagnostických závěrů (tzv. nediagnostický sken). Zlatým zobrazovacím standardem je pak historicky plicní angiografie, která však vykazuje neúměrně vysokou radiační zátěž.
V laboratorní diagnostice se opíráme o vyšetření D-dimerů (degradačních produktů fibrinu).
Než se budeme věnovat konkrétnímu diagnostickému algoritmu, je nutno si ukázat jednotlivé patofyziologické komponenty, jejich význam a sonografické koreláty:
Zdroj embolu
Pokud hovoříme o plicní embolii (PE), máme většinou na mysli embolizaci krevního trombu z žilního systému do plicního řečiště. Další formy PE (vzduchová, tuková, plodovou vodou) nebudou v tomto textu dále zmiňovány a věnovat se budeme pouze trombotické PE.
Zdrojem PE jsou nejčastěji proximální hluboké žíly DKK (iliacké, femorální a popliteální)(19)(20).
Lýtková trombóza (trombus axiálních lýtkových žil a/anebo žil lýtkových svalů) má tendenci embolizovat do plic vzácně a 2/3 lýtkových trombóz se rekanalizuje spontánně bez nutnosti antikoagulační léčby(21). Je však třeba je sledovat, protože 3-32 % z nich progredují do proximálních žil DKK, kde již představují riziko následné embolizace(22)(23) (toto riziko je u DVT provokovaných přechodnými rizikovými faktory na dolní hranici uvedeného rozmezí). Riziko embolizace izolované lýtkové trombózy je pak nízké (3.4 %)(24) a ve velké většině probíhá případná PE bezpříznakově. Někteří autoři doporučují krátkodobou (4-6-ti týdenní) antikoagulační léčbu izolované trombózy jedné z žil lýtka u trombózy provokované přechodným rizikovým faktorem(25)(26)(27)(23). Studie u onkologických pacientů s DVT ukazují, že antikoagulační léčba těchto izolovaných trombóz mortalitu díky vyšší incidenci krvácení nesnižuje(28). Recentní review neshledalo vliv léčby izolované trombózy lýtkových žil na outcome (propagaci trombózy proximálně či plicní embolizaci). V recentních doporučeních se objevují také algoritmy stratifikace rizika těchto pacientů pro rozhodování, zda nasadit léčbu či sledovat(29). V případě sledování vývoje těchto trombóz je pak doporučeno provádět sonografickou kontrolu po jednom a dvou týdnech, v případě progrese příznaků dříve(30).Nutno upozornit, že skupina léčená antikoagulační léčbou byla vždy srovnávána se skupinou bez této léčby, obě skupiny však byly léčeny kompresivními punčochami, na které nesmíme v případě jakékoliv DVT zapomínat(26).
Dalším zdrojem embolů mohou být hluboké žíly pánve, ovariální žíly(31), renální žíly (typicky u pacientů s nefrotickým syndromem či paroxysmální noční hemoglobinurií)(32)(33), či žíly HKK. Tromby mohou vznikat na centrálních žilních katetrech, přímo v pravém srdci či dokonce primárně v arteria pulmonalis(34)(35).
Samotná tromboflebitida povrchových žil DKK je v současné době považována za rizikový faktor PE v případě, kdy trombus zasahuje blíže než 3 cm od safeno-femorální junkce. Rozsah trombózy zjištěný klinickým vyšetřením neodpovídá skutečné extenzi trombu. Proto je zde na místě vyšetření proximální extenze trombózy. Její aktuální rozsah, popř. dynamika v čase pak mohou rozhodovat o nasazení antikoagulační léčby(36).
Trombóza hlubokých žil horních končetin je vzácnější. Zde využíváme opět stanovení předtestové pravděpodobnosti, tentokrát pomocí tzv. Constans skóre.
Můžeme tedy konstatovat, že nejčastějším zdrojem embolů jsou proximální hluboké žíly DKK (iliacké, femorální a popliteální). V případě pátrání po DVT rizikové z embolizace je proto nutno pátrat v těchto lokalizacích. Zdrojem embolu jsou naopak vzácně (do 3 %) hluboké pánevní žíly či VCI(37).
Pokud však pátráme po trombóze v případě suspekce na PE, musíme vyšetřovat i lýtkové žíly (v době prezentace pacienta může být celý proximální trombus dislokován do plicního řečiště) popř. dle anamnézy a kliniky pacienta i další rizikové oblasti (atypické lokalizace zdrojů embolizace, viz výše). Žilní UZ však nebude nikdy dostatečně senzitivní k vyloučení trombózy hlubokých žil DKK či trombózy v jiné, nezvyklé lokalizaci (např. v oblasti lýtka dosahuje senzitivita sonografie 70 %)(38).
U již prokázané PE je doporučeno provádět vyšetření hlubokých žil a hledat možný zdroj embolizace. Přítomnost DVT u potvrzené PE je považována za nezávislý rizikový faktor její 30 ti-denní mortality.
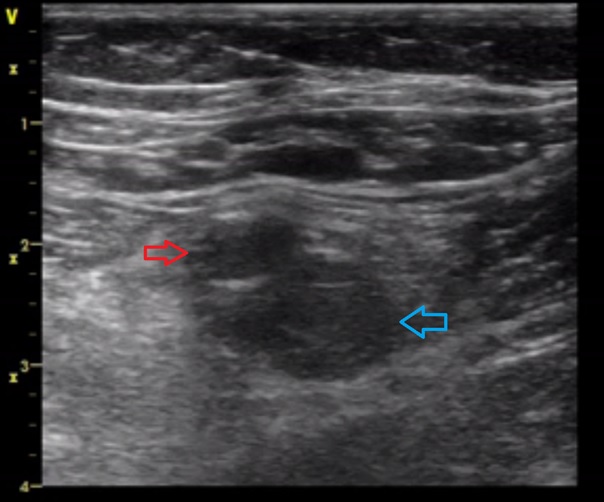
Obr.: Hluboká žilní trombóza.
Příčné zobrazení femorálního cévního svazku cca 5 cm po tříselným vazem. Snímek pořízen během kontrolované komprese, kdy je mírně stlačen lumen art.femoralis (červeně), vena femoralis superficialis je nekompresibilní s viditelným echogenním trombem vyplňujícím při kompresi celé lumen cévy (modře).
Plicní infarkty
Masivní plicní embolizace vede k okamžité klinicky závažné reakci daleko dříve, než se stihne vytvořit plicní infarkt. Embolizace subsegmentálních větví vede k jejich uzávěru, současně se kompenzačně zvyšuje perfuze z větví bronchiálních tepen, ovšem pod systémovým tlakem. Porucha perfuze vede ke zhroucení surfaktantu a atelektáze subsegmentu zásobovaného danou cévou. Při vyšším perfuzním tlaku a poruše permeability kapilár dochází k intraalveolární hemorhagii. Pokud následně nedostačuje nutritivní perfuze z větví bronchiálních tepen, dochází k nekróze (plicnímu infarktu). Ložiska atelektázy a nekrotizace pak odpovídají subsegmentárnímu cévnímu zásobení a postihují subpleurální části plic. Kaptein et al. zmiňují rozdíl mezi takovouto hemorhagickou infarzací s možností restituce ad integrum a skutečnými infarkty, které následně podléhají fibrotické přestavbě a zůstává po nich jizva(39). V akutní fázi nejsou od sebe tyto pravé a ,,nepravé,, infarkty pomocí zobrazovacích metod odlišitelné, to až v pozdní fázi během reparace anebo biopticky. Tato ložiska se nacházení převážně v dorzálních partiích plic, mají velikost cca 15x12mm, jsou klínovitého či oválného tvaru s ostrým ohraničením vůči okolnímu plicnímu parenchymu, někdy doprovázené pleurální reakcí (drobný fluidothorax, klinicky pak pleurální bolest). Průměrně je takto nalézáno 2,3 ložisek(40). Ve 20% je v centru těchto konsolidací nalézán ojedinělý hyperechogenní air-bronchogram(41). Senzitivita LUS v diagnostice plicní embolie je literárně udávána od 74-80 %, specificita výše uvedených nálezů pak 92-94 % s diagnostickou přesností 84 %(42)(43). Na vrcholu konsolidace může být patrný cévní tok, který je pak dále do periferie amputován – tzv. vascular sign (viz kapitola 16). Nález těchto ložisek u pacientů s klinicky závažným průběhem PE může signalizovat předchozí sukcesivní embolizaci menších embolů do periferie předcházející aktuální masivní embolizaci do hlavních větví plicnice. Jedna z prvních metaanalýz z roku 2009 ukázala vysokou senzitivitu i specificitu LUS v diagnostice PE (80% a 93%)(44) . Metaanalýza z roku 2021 zahrnující 16 studií s 1916 pacienty shrnula aktuální možnosti TUS v diagnostice PE (senzitivita 82 %, specificita 89 %, AUC 0.91) (41). LUS se může uplatnit i jako metoda pro sledování těchto infarktů a ev. detekci komplikací (kavitace či abscedace, bronchopleurální píštěl s PNO či empyémem). Při výskytu pleuritické bolesti u stabilní pacientů je LUS dostatečně senzitivní (93%) a negativně prediktivní (96.2%) i pokud je provedeno jen v místě udávané bolesti a může v této situaci nahradit kompletní vyšetření hrudníku pomocí LUS(81). V současnosti se plicní sonografie nenachází v doporučeních pro diagnostiku PE, lze ji však zvážit při nemožnosti provést CTPA.
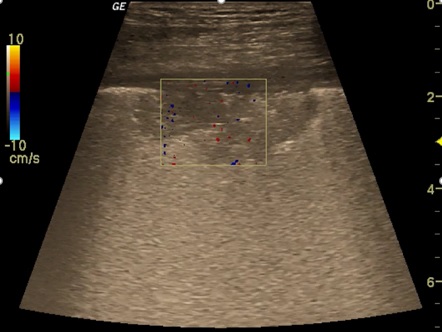
Obr.: Plicní infarkt.
Subpleurálně uložená oválná konsolidace bez prokazatelné perfuze k okolní vzdušné plíci, ohraničení vůči vzdušné plíci relativně ostré. Na CT angiografii potvrzena subsegmentální embolizace centrálně od lokalizace této konsolidace.
V možnostech sonografie je i zobrazení perfuze subpleurálních konsolidací pomocí kontrastní sonografie (CEUS), kdy u PE prokazujeme výpadek bezprostřední arteriální perfuze (do 6.-8. sekundy po podání kontrastní látky) jako známku uzavřené perfuze větvemi plicnicové tepny, v pozdější fázi vyšetření můžeme detekovat slabší nepravidelnou perfuzi z větví bronchiálních tepen(45). Problémem může být nález morfologicky pro PE typické subpleurální konsolidace a současně negativity CTPA vyšetření. Závěr vyšetření LUS dle typických charakteristik v B-mode jako suspektní PE je v tomto případě falešně pozitivní (referenční metoda CTPA je negativní). Co když je ale naopak CTPA v tomto případě falešně negativní? Na takováto ložiska se podívala skupina okolo Coriny Trenker et al.(46). Ložiska morfologicky suspektní z plicních infarktů ale s negativními nálezy CTPA vyšetřili pomocí CEUS a následně korelovali i s histologickým vyšetřením (47). U všech pacientů ukázalo histologické vyšetření plicní infarkt, u jednoho šlo současně i o plicní karcinom. Jednalo se sice o velmi malou sérii případů, podobné nálezy se však ukázaly i v dalších studiích během pandemie COVID-19 (48)(49). CEUS se tedy zdá senzitivnější pro detekci embolické či trombotické etiologie některých drobných subpleurálních konsolidací než CTPA. V případě absence regrese nálezu je poté vždy namístě histologická verifikace subpleurálních ložisek.
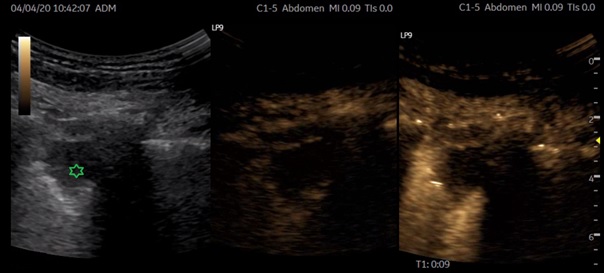
Obr.: Plicní infarkt v CEUS.
Klínovitá subpleurální konsolidace velikosti cca 2×2 cm zobrazena v B-mode (zeleně), uprostřed pak korespondující obraz konsolidace v módu pro kontrastní vyšetření s nízkým MI. V 9.sekundě po podání kontrastní látky lze v pravé části obrazu pozorovat zvýraznění artefaktů vycházejících z vzdušné plíce díky perfuzi přes větve pulmonální arterie, ve vlastní konsolidaci však k sycení nedochází.
Důležitou práci publikovala německá skupina autorů, kteří se věnovali sledování vývoje ložisek subpleurálních konsolidací při PE v čase (80). V krátkodobém horizontu (1-2 týdny) ložiska přetrvávala bez signifikantní regrese, v horizontu 10-ti týdnů již docházelo k významnému zmenšení ložisek. Zajímavým zjištěním byl vývoj charakteru sycení těchto konsolidací, kdy ne vždy bylo pozorováno obnovení homogenní perfuze. Toto spolu s pomalou regresí činí odlišení těchto konsolidací (např. jako náhodného nálezu bez kliniky PE) od tumoru obtížné.
In-transit tromby
Nález in-transit trombů během echokardiografického vyšetření je jasným průkazem PE a může indikovat trombolytickou či chirurgickou léčbu i za současné hemodynamické stability(42).
Přetížení pravého srdce
Žádný z parametrů přetížení pravého srdce není dostatečně specifický ani senzitivní pro PE. Hodnotí se dilatace a dysfunkce pravé komory, 60/60 příznak, McConnelův příznak či hodnocení tvaru spektrální křivky toku v plicnicové tepně. K odlišení dysfunkce pravé komory vyvolané tlakovým přetížením od dysfunkce pravé komory při její ischemii (infarkt pravé komory) může pomoci detekce tlakového přetížení (nález elevace tlaku v plicnici a paradoxní pohyb IVS na konci systoly komor). Důležité je odlišení akutního od chronického přetížení pravé komory – případná hypertrofie stěny pravé komory (nad 6 mm) je jasnou známkou chronického stavu a případnou dysfunkci pravé komory pak nelze spolehlivě označit jako akutní a tedy suspektní z právě probíhající epizody významné plicní embolizace.
Stanovení rizikovosti zjištěné PE je zásadní pro rozhodnutí o terapeutickém postupu. Klinicky lze posoudit závažnost a další rizikovost již diagnostikované PE pomocí zavedených skórovacích systémů– doporučovány jsou například skóre PESI (PE severity index) a sPESI (simplified PESI). Můžeme však použít i známky přetížení pravé komory zjištěné echokardiograficky či laboratorně (jako elevace troponinu)(50). U masivní PE prokazujeme dysfunkci pravého srdce za současné hemodynamické nestability, u submasivní je přítomna dysfunkce pravé komory, hemodynamika je však stabilní. Ke kvantifikaci tíže dysfunkce RV a tím rozhodnutí o vhodné léčbě nám může pomoci zhodnocení Tei indexu či strain analýza pravé komory(51). Obě metody přinášejí nižší variabilitu výsledků mezi vyšetřujícími a tímto přesněji objektivizují RV dysfunkci než klasické parametry jako jsou TAPSE, RV-FAC či vizuální zhodnocení dysfunkce pravé komory. Zjištěná významná dysfunkce pravé komory pak podstatně zhoršuje outcome pacientů neléčených trombolýzou a její odhalení může vést k úvaze podání této léčby u i t.č. hemodynamicky stabilních pacientů.
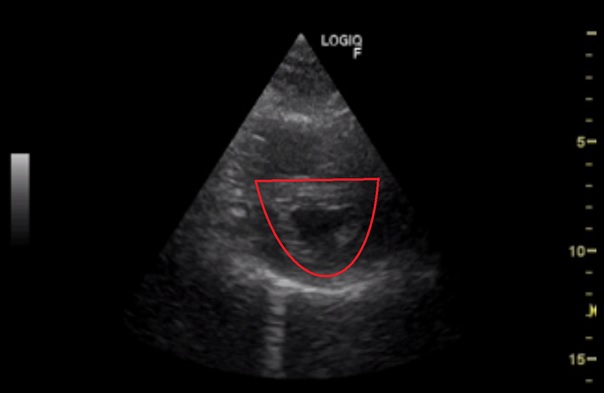
Obr.: D-shape levé komory.
Subkostální příčná projekce v úrovni papilárních svalů. Levá komora v příčném řezu je nefyziologicky ve tvaru D (červeně).
Vlastní diagnostický postup
Vlastní diagnostický postup vychází jak ze stanovené předtestové pravděpodobnosti přítomnosti PE, tak i z aktuálního stavu pacienta (hemodynamické stability pacienta, přání pacienta, alergií, komorbidit, gravidity apod.), dostupnosti jednotlivých diagnostických modalit, jejich rizik, rizika falešné pozitivity či negativity jejich výsledků a ceny těchto vyšetření.
Současný pokrok ve zobrazovacích metodách vedl k zvýšení detekce PE, avšak bez současného trendu ke snížení mortality(52). Nabízí se tedy otázka, zda nediagnostikujeme a neléčíme PE, které nemají vliv na outcome a zda naopak nemíjíme ty, které pacienty zabíjejí(53)? U pacientů zemřelých z jiné příčiny jsou nalézány plicní emboly v 20-50 %(54), jedná se tedy o běžnou patologii nezasluhující ve všech případech terapeutický zásah. Některé studie pak ukazují, že v případě vyloučení hluboké žilní trombózy lze u skupiny pacientů s nízkým rizikem rekurence od antikoagulační léčby dokonce ustoupit(55). Riziko závažného krvácení plynoucí z antikoagulační léčby je v tomto případě vyšší než riziko závažné rekurentní tromboembolické komplikace (5.3 % vs. 0.7 %)(56).
Vždy je třeba si uvědomit, zda se jedná o pacienta hemodynamicky stabilního nebo nestabilního. Jako nestabilního považujeme pacienta, který je hypotenzní (TKs pod 90mmHg nebo TKs s poklesem o min. 40mmHg po dobu min.15 minut) nebo má potřebu vazopresorické či inotropní podpory a tato hypotenze není tč. vysvětlitelná jinou příčinou (např. hypovolémie, vazodilatace, významná dysfunkce levé komory). Hemodynamický dopad PE je vždy výsledkem tíže obstrukce plicního řečiště a míry schopnosti pravého srdce kompenzovat zvýšenou plicní vaskulární rezistenci. I menší emboly mohou u již preexistující dysfunkce pravého srdce vést k hemodynamické nestabilitě a vice versa.
Diagnostické algoritmy se poté liší podle stupně pravděpodobnosti přítomnosti PE či DVT u konkrétního pacienta. V případě nízké a střední klinické pravděpodobnosti využíváme jako první diagnostickou metodu vysoce senzitivní D-dimery, případně kombinujeme prediktivní kalkulace o nález LUS, které může dále předtestovou pravděpodobnost upřesnit a pomoci v rozhodnutí, zda indikovat další zobrazovací metodu(81). Pokud je výsledek negativní, s vysokou mírou spolehlivosti považujeme přítomnost PE/DVT za vyloučenou. U ambulantních pacientů se nabízí dokonce možnost stanovit tzv. PERC skóre (Pulmonary Embolism Rule-out Criteria, tab.3) a v případě jeho negativity neprovádět ani vyšetření D-Dimerů.
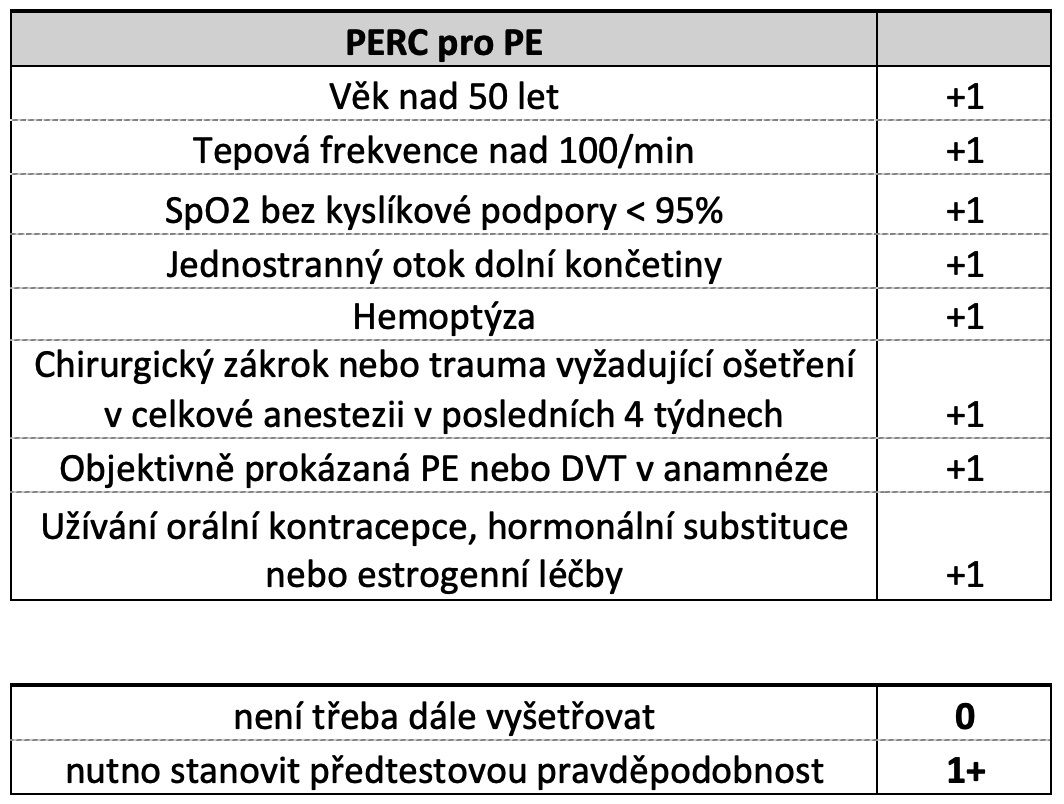
Tab.: PERC vylučovací kritéria.
Stanovení D-dimerů má smysl u pacientů s nízkou (ev. střední) předtestovou pravděpodobností PE. U vysoké pravděpodobnosti je již negativní prediktivní hodnota testu ke spolehlivému vyloučení PE bez dalších zobrazovacích vyšetření nedostatečná a jeho použití není v diagnostice u tohoto rizika doporučeno(57). Toto doporučení však vychází z poznatků testování D-dimerů staršími metodami. Novější práce s použitím vysoce senzitivních D-dimerů (rapid ELISA, kvantitativní imunoturbidometrie) již prokazují dostatečnou negativní prediktivní hodnotu nejen u nízkého, ale i středního předtestového rizika PE (Wellsovo skóre 4.5-6.0, revidované Ženevské skóre 3-10)(58) i při použití vyšších cut-off hodnot D-dimerů. Tyto výsledky tedy favorizují užití modifikovaných prediktivních skóre (modifikované Wellsovo či Ženevské skóre), jejichž výsledek je kategorizován pouze do dvou hodnot (nízká nebo vysoká pravděpodobnost)(59).
U předtestové pravděpodobnosti přítomnosti PE D-dimery v diagnostice vynecháváme. Falešná negativita v této skupině je vysoká, okolo 15 %, D-dimery tedy použít nemůžeme(60).
Při hodnocení vysoce senzitivních D-dimerů je doporučeno používat na věk korigované cut-off hodnoty, kdy u pacientů nad 50 let bereme jako horní hranici normy hodnoty D-dimerů věk x 10 (ug/l), u mladších pak 500 ug/ml(61). Cut-off hodnotu D-Dimerů je možno korigovat u konkrétního pacienta i dle výše předtestové pravděpodobnosti PE(62), kdy můžeme u pacientů s nízkou předtestovou pravděpodobností posunou naši cut-off hodnotu až na 1000 ug/ml(63). Význam stanovení D-Dimerů je v jeho vysoké negativní prediktivní hodnotě u pacientů s nízkým a středním předtestovým rizikem pro PE(58).
Jako první zobrazovací metoda bývá doporučováno provedení CTPA. V aktuálních doporučeních Americké hematologické společnosti (ASH) se u pacientů s nízkým a středním rizikem objevuje jako první metoda volby V/Q sken, u vysoké pravděpodobnosti trvá doporučení použít jako první CTPA. V/Q sken není doporučen při preexistujícím plicním onemocnění, aktuálním patologickém nálezu na rtg snímku plic, u osob vyššího věku a u jeho časové nebo logistické nedostupnosti.
U pacientů s alergií na kontrastní látku či renální dysfunkcí by měla být namísto CTPA první modalitou sonografie žil DKK. V případě pozitivního nálezu DVT může být pacient léčen antikoagulancii a další diagnostika (např. CTPA) nemá smysl. V případě negativního UZ žil DKK pak lze zvážit V/Q sken, popřípadě dočasné nasazení antikoagulace a odložené provedené CTPA po zlepšení renálních funkcí(64). U žen v reproduktivním věku a těhotných je díky vysoké radiační zátěži CTPA na prsní žlázu vhodný stejný algoritmus. U těhotných je důležité si uvědomit, že radiační zátěž pro plod je vyšší v případě použití V/Q skenu než při adekvátně odstíněné CTPA(65) a že kontrastní látka pro CTPA není pro plod škodlivá(66)(67). U těhotných je při ultrazvukovém vyšetřené důležité i prohlédnutí iliackých žil (zde nutně s použitím Dopplera).
Na druhé straně rizikovosti stojí skupina pacientů s falešně negativní CTPA. Práce udávají incidenci okolo 1.4 %, která je srovnatelná s negativitou klasické plicní angiografie(68). Uvedenou falešnou negativitu můžeme dále snížit použitím sonografie žil DKK u pacientů s nejvyšší předtestovou pravděpodobností PE a současném negativním CPTA nálezu.
V případě suspekce na DVT žil horních končetin používáme tzv. Constans skóre ke klasifikaci klinického rizika přítomnosti trombu. U nízké pravděpodobnosti (Constans skóre 0-1) použijeme D-dimery, v případě jejich negativity uzavíráme diagnostiku jako negativní. U pravděpodobné DVT (Constans skóre 2-3) se rozhodujeme individuálně, můžeme opět použít D-dimery či rovnou sonografii – zde duplexní vyšetření i s použitím Dopplera. Pokud budeme uvažovat o PE a zdroji embolu v žilách HKK, negativní nález na sonografii neumožňuje uzavřít suspekci jako negativní a je třeba přistoupit k pátrání po embolu a jeho konsekvencích v srdci, plicním oběhu či ve vlastní plíci.
Problematická je diagnostika recidivující PE a DVT. V případě suspekce na recidivu DVT je doporučena kompresivní sonografie žil DKK a srovnání s posledním nálezem. Nález trombózy v nové lokalizaci či trombus vedoucí k vzestupu průměru lumen nestlačitelné žíly nad 2-4 mm oproti předchozímu vyšetření je průkazem recidivy(69). V případě vyšetření plicního oběhu je pak vhodné použít stejnou metodu, která byla použita v diagnostice předchozí PE a nálezy srovnat.
Léčba pacientů s PE
Pokud jsme u pacienta diagnostikovali PE, zvolená léčba odpovídá rizikovosti této PE. Tato rizikovost je určena mírou dopadu obstrukce plicního řečiště na pravé srdce. Důležitá je i doba nasazení první dávky antikoagulancia, kdy aktuální doporučení považují jeho podání vhodné již při stanovení střední či vysoké předtestové pravděpodobností PE, tedy ještě před zahájením vlastního zobrazovacího vyšetření(62).
K zhodnocení přetížení pravého srdce používáme zhodnocení aktuální hemodynamické stability, laboratorní metody (troponin, natriuretické peptidy, H-FABP) a zobrazovací metody. Jako hlavní metodu zhodnocení přetížení pravého srdce pak máme k dispozici echokardiografii. Mezi známky významné dysfunkce pravé komory patří její dilatace (poměr průměru RV:LV nad 1), TAPSE pod 16 mm, D-shape levé komory, S´-vlna trikuspidálního anulu pod 9.5 cm/s v TDI či pokles globálního strainu volné stěny RV. Výhodou echokardiografie je i možnost detekovat přítomnost pravolevého zkratu, který se může při anatomické predispozici (PFO, ASD) díky elevaci afterloadu pravé komory vyvolat/zhoršit a prohlubovat tímto hypoxémii.
Kombinací parametrů můžeme přesněji stratifikovat riziko nepříznivého outcome a tímto ,,titrovat,, agresivitu léčby PE. Nejrozšířenějším je PESI (Pulmonary Embolism Severity Index), který dále kombinujeme s výše zmíněnými indikátory přetížení pravé komory. Užitečnost stanovení stupně rizika je v identifikaci pacientů s nízce rizikovou PE schopných domácí léčby a poté v odlišení dvou skupin pacientů se středním rizikem – vyššího středního a nižšího středního stupně rizika. Dokonce i u nízkého rizika dle PESI je doporučeno zkontrolovat jeden z výše uvedených parametrů ukazujících na dysfunkci pravé komory a při jeho přítomnosti poté rizikovost přehodnotit do vyšší kategorie (nižší střední riziko, doporučení kategorie IIa)(62). Vyšší střední stupeň rizikovosti pak vyžaduje vyšší stupeň monitorace a připravenost rychle podat trombolytickou rescue léčbu v případě další deteriorace stavu.
U hemodynamicky závažné PE budeme častěji používat katecholaminy, sedaci, umělou plicní ventilaci, tedy metody vyžadující podávání většího množství agresivních léčiv do žilního oběhu. Stejně tak budeme častěji nasazovat trombolýzu, naprostou většinu pacientů budeme plně antikoagulovat. Budeme se tedy dostávat do konfliktu nutnosti zajištění invazivních vstupů (CŽK, arteriální kanyly, popř. zavedení kanyl pro ECMO) v situaci plné antikoagulace a trombolýzy. Ultrazvuková navigace zde prokáže službu a povede v rukou zkušeného týmu ke snížení rizika krvácivých komplikací při kanylacích v tomto období.
Další využití sonografie v managementu pacienta s PE
Délka a ukončení antikoagulační léčby
U izolované lýtkové trombózy je po 3 měsících antikoagulační léčby rozpuštěno cca 50 % trombů, po 6 měsících všechny(70). Jak jsme zmínili v úvodu, panují rozdílné názory na zahájení léčby u izolované trombózy jedné z lýtkových žil. Při srovnání efektu antikoagulační léčby trombózy jedné nebo více lýtkových žil došli Ferrara a kolektiv ve své studii k závěru, že při postižení více než jedné z žil lýtka je nutno léčbu nasadit a pokračovat v ní po dobu minimálně 3 měsíců(71).
U trombóz proximálních žil DKK je situace horší a reziduální trombóza při ukončování léčby je prokazována v 50-70 % případů(72). Starší studie zabývající se detekcí reziduálního trombu po iniciální antikoagulační léčbě a jeho vlivu na outcome pacienta ukázaly, že přítomnost reziduálního trombu je rizikovým faktorem rekurence DVT a že prodloužení antikoagulační terapie může přinést klinický benefit(72)(73). Jako známka rekanalizace je brán průměr žíly pod 2 mm během komprese nebo pod 3 mm ve dvou následujících vyšetřeních. V novějších studiích se však tato tvrzeni nepotvrdila(74)(75)(76), evidence pro doporučení prodloužení antikoagulace je zde tedy nízká.
V době ukončení antikoagulační terapie je jednoznačně doporučeno kontrolní UZ vyšetření k popisu event. reziduálního trombu (nověji pro odlišení od skutečného trombu doporučeno označovat jako chronické posttrombotické změny)(30) jako výchozí hodnoty pro event. další vyšetření při suspekci na rekurenci DVT(29)(69). Jako rekurenci trombózy pak označujeme nález trombu v nové lokalizaci či signifikantní nárůst velikosti reziduálního trombu (navržena hranice nárůstu nad 3-4 mm)(77). V případě diagnostické nejistoty je nutno provést sérii vyšetření a sledovat event. vývoj nálezu (0., 1.-3. a 7.-10.den)(30).
Diagnostika rekurentní PE
Dokumentace charakteru a rozsahu reziduálních trombů při ukončování antikoagulační terapie může mít využití při pozdějším opětovném podezření na PE(78). Zde je poté často vhodné odlišení čerstvé trombózy žil DDK od starší rekanalizující se trombózy, protože více než 50 % pacientů má po 6ti-měsíční antikoagulační léčbě přetrvávající defekty ve V/Q skenu (patologický nález na CPTA mizí dříve)(79).
Chronické komplikace PE
- Chronická tromboembolická plicní hypertenze (CTEPH)
Po 3-6 měsících od epizody PE je doporučena evaluace symptomů pacienta (dušnost, limitace fyzické výkonosti). Při přetrvávajících obtížích je doporučena jako první krok TTE ke zhodnocení rizika přítomnosti plicní hypertenze. V případě středního a vyššího rizika její přítomnosti je pak dále doporučeno provedení V/Q skenu a při přítomnosti oblastí s nepoměrem ventilace a perfuze odeslání pacienta ke konzultaci do CTEPH centra(62).
- Posttrombotický syndrom
Zde odkazujeme na publikace věnující se podrobně žilní sonografii. Možnosti odlišení rekurence od chronických trombotických změn jsme již zmínili.
Reference
- Partsch H. Therapy of deep vein thrombosis with low molecular weight heparin, leg compression and immediate ambulation. Vasa – Journal of Vascular Diseases. 2001;30(3):195–204.
- Stein PD, Beemath A, Matta F, Weg JG, Yusen RD, Hales CA, et al. Clinical Characteristics of Patients with Acute Pulmonary Embolism: Data from PIOPED II. American Journal of Medicine. 2007 Oct;120(10):871–9.
- Busby W, Bayer A, Pathy J. Pulmonary embolism in the elderly. Age and Ageing. 1988;17(3):205–9.
- Lijfering WM, Rosendaal FR, Cannegieter SC. Risk factors for venous thrombosis – Current understanding from an epidemiological point of view. Vol. 149, British Journal of Haematology. Br J Haematol; 2010. p. 824–33.
- Fazel R, Froehlich JB, Williams DM, Saint S, Nallamothu BK. A Sinister Development. New England Journal of Medicine. 2007 Jul 5;357(1):53–9.
- Wells PS, Anderson DR, Rodger M, Ginsberg JS, Kearon C, Gent M, et al. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: Increasing the models utility with the SimpliRED D-dimer. Thrombosis and Haemostasis. 2000;83(3):416–20.
- Huisman M V. Effectiveness of managing suspected pulmonary embolism using an algorithm combining clinical probability, D-dimer testing, and computed tomography. Journal of the American Medical Association. 2006 Jan 11;295(2):172–9.
- Zhang LJ, Zhang Z, Li SJ, Meinel FG, Nance JW, Zhou CS, et al. Pulmonary embolism and renal vein thrombosis in patients with nephrotic syndrome: Prospective evaluation of prevalence and risk factors with CT. Radiology. 2014 Dec 1;273(3):897–906.
- Doğan H, de Roos A, Geleijins J, Huisman M, Kroft L. The role of computed tomography in the diagnosis of acute and chronic pulmonary embolism. Vol. 21, Diagnostic and Interventional Radiology. AVES Ibrahim Kara; 2015. p. 307–16.
- Ghaye B, Ghuysen A, Willems V, Lambermont B, Gerard P, D’Orio V, et al. Severe pulmonary embolism: Pulmonary artery clot load scores and cardiovascular parameters as predictors of mortality. Vol. 239, Radiology. Radiology; 2006. p. 884–91.
- Mastora I, Remy-Jardin M, Masson P, Galland E, Delannoy V, Bauchart JJ, et al. Severity of acute pulmonary embolism: Evaluation of a new spiral CT angiographic score in correlation with echocardiographic data. European Radiology. 2003 Jan 1;13(1):29–35.
- Nural MS, Elmali M, Findik S, Yapici O, Uzun O, Sunter AT, et al. Computed tomographic pulmonary angiography in the assessment of severity of acute pulmonary embolism and right ventricular dysfunction. Acta Radiologica. 2009;50(6):629–37.
- Remy-Jardin M, Pistolesi M, Goodman LR, Gefter WB, Gottschalk A, Mayo JR, et al. Management of suspected acute pulmonary embolism in the era of CT angiography: A statement from the Fleischner Society. Vol. 245, Radiology. Radiology; 2007. p. 315–29.
- Albrecht MH, Bickford MW, Nance JW, Zhang L, De Cecco CN, Wichmann JL, et al. State-of-the-Art pulmonary CT angiography for acute pulmonary embolism. Vol. 208, American Journal of Roentgenology. American Roentgen Ray Society; 2017. p. 495–504.
- Burris AC, Boura JA, Raff GL, Chinnaiyan KM. Triple Rule Out Versus Coronary CT Angiography in Patients with Acute Chest Pain Results from the ACIC Consortium. JACC: Cardiovascular Imaging. 2015 Jul 1;8(7):817–25.
- Meyer M, Haubenreisser H, Sudarski S, Doesch C, Ong MM, Borggrefe M, et al. Where do we stand? Functional imaging in acute and chronic pulmonary embolism with state-of-the-art CT. European Journal of Radiology. 2015;84(12):2432–7.
- Zhang LJ, Zhou CS, Schoepf UJ, Sheng HX, Wu SY, Krazinski AW, et al. Dual-energy CT lung ventilation/perfusion imaging for diagnosing pulmonary embolism. European Radiology. 2013 Oct;23(10):2666–75.
- Miller WT, Marinari LA, Barbosa E, Litt HI, Schmitt JE, Mahne A, et al. Small pulmonary artery defects are not reliable indicators of pulmonary embolism. Annals of the American Thoracic Society. 2015 Jul 1;12(7):1022–9.
- van Langevelde K, Šrámek A, Vincken PWJ, van Rooden JK, Rosendaal FR, Cannegieter SC. Finding the origin of pulmonary emboli with a total-body magnetic resonance direct thrombus imaging technique. Haematologica. 2013 Feb 1;98(2):309–15.
- Tadlock MD, Chouliaras K, Kennedy M, Talving P, Okoye O, Aksoy H, et al. The origin of fatal pulmonary emboli: A postmortem analysis of 500 deaths from pulmonary embolism in trauma, surgical, and medical patients. American Journal of Surgery. 2015 Jun 1;209(6):959–68.
- Righini M, Bounameaux H. Clinical relevance of distal deep vein thrombosis. Vol. 14, Current Opinion in Pulmonary Medicine. 2008. p. 408–13.
- Kearon C. Natural history of venous thromboembolism. Vol. 107, Circulation. Circulation; 2003.
- Masuda EM, Kistner RL, Musikasinthorn C, Liquido F, Geling O, He Q. The controversy of managing calf vein thrombosis. Vol. 55, Journal of Vascular Surgery. J Vasc Surg; 2012. p. 550–61.
- Hach-Wunderle V, Düx M, Hoffmann A, Präve F, Zegelman M, Hach W. Therapie bei tiefer bein- und beckenvenenthrombose. Deutsches Arzteblatt. 2008;105(1–2):23–34.
- Pinede L, Ninet J, Duhaut P, Chabaud S, Demolombe-Rague S, Durieu I, et al. Comparison of 3 and 6 months of oral anticoagulant therapy after a first episode of proximal deep vein thrombosis or pulmonary embolism and comparison of 6 and 12 weeks of therapy after isolated calf deep vein thrombosis. Circulation. 2001 May 22;103(20):2453–60.
- Schwarz T, Buschmann L, Beyer J, Halbritter K, Rastan A, Schellong S. Therapy of isolated calf muscle vein thrombosis: A randomized, controlled study. Journal of Vascular Surgery. 2010;52(5):1246–50.
- Lautz TB, Abbas F, Walsh SJN, Chow C, Amaranto DJ, Wang E, et al. Isolated gastrocnemius and soleal vein thrombosis: Should these patients receive therapeutic anticoagulation? Annals of Surgery. 2010 Apr;251(4):735–42.
- Brahmandam AS, Brownson K, Skrip L, Parker T, Indes J, Sarac T, et al. Management of isolated calf vein thrombosis in cancer patients. Vascular. 2016 Feb 1;24(1):64–9.
- Mazzolai L, Aboyans V, Ageno W, Agnelli G, Alatri A, Bauersachs R, et al. Diagnosis and management of acute deep vein thrombosis: A joint consensus document from the European Society of Cardiology working groups of aorta and peripheral vascular diseases and pulmonary circulation and right ventricular function. Vol. 39, European Heart Journal. Oxford University Press; 2018. p. 4208–18.
- Needleman L, Cronan JJ, Lilly MP, Merli GJ, Adhikari S, Hertzberg BS, et al. Ultrasound for lower extremity deep venous thrombosis: Multidisciplinary recommendations from the society of radiologists in ultrasound consensus conference. Circulation. 2018 Apr 3;137(14):1505–15.
- Verde F, Johnson PT. One not to miss: Ovarian vein thrombosis causing pulmonary embolism with literature review. Journal of Radiology Case Reports. 2012 Sep;6(9):23–8.
- Singhal R, Brimble KS. Thromboembolic complications in the nephrotic syndrome: Pathophysiology and clinical management. Thrombosis Research. 2006;118(3):397–407.
- Griffin M, Munir T. Management of thrombosis in paroxysmal nocturnal hemoglobinuria: a clinician’s guide. Therapeutic Advances in Hematology. 2017 Mar;8(3):119–26.
- Wayangankar SA, Patel J, Latif F, Sivaram C. Right atrial septal pouch-A potential nidus for thrombosis. Echocardiography. 2012 Jan;29(1).
- Dessap AM, Deux JF, Abidi N, Lavenu-Bombled C, Melica G, Renaud B, et al. Pulmonary artery thrombosis during acute chest syndrome in sickle cell disease. American Journal of Respiratory and Critical Care Medicine. 2011 Nov 1;184(9):1022–9.
- Cosmi B. Management of superficial vein thrombosis. Vol. 13, Journal of Thrombosis and Haemostasis. Blackwell Publishing Ltd; 2015. p. 1175–83.
- Stein PD, Fowler SE, Goodman LR, Gottschalk A, Hales CA, Hull RD, et al. Multidetector Computed Tomography for Acute Pulmonary Embolism. New England Journal of Medicine. 2006 Jun;354(22):2317–27.
- Kearon C, Julian JA, Newman TE, Ginsberg JS. Noninvasive diagnosis of deep venous thrombosis. Vol. 128, Annals of Internal Medicine. American College of Physicians; 1998. p. 663–77.
- Kaptein FHJ, Kroft LJM, Hammerschlag G, Ninaber MK, Bauer MP, Huisman M V., et al. Pulmonary infarction in acute pulmonary embolism. Thrombosis Research. 2021;202(March):162–9.
- Mathis G, Blank W, Reißig A, Lechleitner P, Reuß J, Schuler A, et al. Thoracic ultrasound for diagnosing pulmonary embolism: A prospective multicenter study of 352 patients. Chest. 2005;128(3):1531–8.
- Chen W, Xu K, Li Y, Hao M, Yang Y, Liu X, et al. Clinical value of thoracic ultrasonography in the diagnosis of pulmonary embolism: a systematic review and meta-analysis. Medical Ultrasonography. 2021;1–9.
- UpToDate – Evidence-based Clinical Decision Support | Wolters Kluwer [Internet]. [cited 2021 Jul 5]. Available from: https://www.wolterskluwer.com/en/solutions/uptodate
- Comert SS, Caglayan B, Akturk U, Fidan A, Kiral N, Parmaksiz E, et al. The role of thoracic ultrasonography in the diagnosis of pulmonary embolism. Annals of Thoracic Medicine. 2013;8(2):99–104.
- Niemann T, Egelhof T, Bongartz G. Transthoracic sonography for the detection of pulmonary embolism – A meta-analysis. Ultraschall in der Medizin. 2009;30(2):150–6.
- Görg C. Transcutaneous contrast-enhanced sonography of pleural-based pulmonary lesions. European Journal of Radiology. 2007.
- Trenker C, Apitzsch JC, Pastor S, Bartelt S, Neesse A, Goerg C. Detection of peripheral embolic consolidations using contrast-enhanced ultrasonography in patients with no evidence of pulmonary embolism on computed tomography: A pilot study. Journal of Clinical Ultrasound [Internet]. 2017 Nov 12;45(9):575–9. Available from: https://doi.org/10.1002/jcu.22511
- Trenker C, Dohse M, Ramaswamy A, Michel C, Görg C. Histological validation of pulmonary infarction detected with contrast-enhanced ultrasound in patients with negative computed tomography pulmonary angiogram: A case series. Journal of Clinical Ultrasound. 2019 Oct 1;47(8):461–5.
- Safai Zadeh E, Beutel B, Dietrich CF, Keber CU, Huber KP, Görg C, et al. Perfusion patterns of peripheral pulmonary lesions in COVID-19 patients using contrast-enhanced ultrasound (CEUS): A case series. Journal of Ultrasound in Medicine. 2021;1–9.
- Yusuf GT, Wong A, Rao D, Tee A, Fang C, Sidhu PS. The use of contrast-enhanced ultrasound in COVID-19 lung imaging. Journal of Ultrasound. 2020;(0123456789).
- De Baynast Q, Hauguel-Moreau M, Vieillard-Baron A, Szymanski C, Dubourg O, Mansencal N. Prognosis assessment of acute pulmonary embolism by multimodality imaging: Is it really necessary? Archives of Cardiovascular Diseases Supplements. 2021 Jun;13(3):265–6.
- Dahhan T, Siddiqui I, Tapson VF, Velazquez EJ, Sun S, Davenport CA, et al. Clinical and echocardiographic predictors of mortality in acute pulmonary embolism. Cardiovascular Ultrasound. 2016 Oct 28;14(1):1–9.
- Burge AJ, Freeman KD, Klapper PJ, Haramati LB. Increased diagnosis of pulmonary embolism without a corresponding decline in mortality during the CT era. Clinical Radiology. 2008 Apr;63(4):381–6.
- Carrier M, Righini M, Wells PS, Perrier A, Anderson DR, Rodger MA, et al. Subsegmental pulmonary embolism diagnosed by computed tomography: Incidence and clinical implications. A systematic review and meta-analysis of the management outcome studies. Journal of Thrombosis and Haemostasis. 2010 Aug;8(8):1716–22.
- Goodman LR. Small pulmonary emboli: What do we know? Vol. 234, Radiology. Radiology; 2005. p. 654–8.
- Stein PD, Goodman LR, Hull RD, Dalen JE, Matta F. Diagnosis and management of isolated subsegmental pulmonary embolism: Review and assessment of the options. Vol. 18, Clinical and Applied Thrombosis/Hemostasis. SAGE PublicationsSage CA: Los Angeles, CA; 2012. p. 20–6.
- Donato AA, Khoche S, Santora J, Wagner B. Clinical outcomes in patients with isolated subsegmental pulmonary emboli diagnosed by multidetector CT pulmonary angiography. Thrombosis Research. 2010 Oct 1;126(4):e266–70.
- Ten Cate-Hoek AJ, Prins MH. Management studies using a combination of D-dimer test result and clinical probability to rule out venous thromboembolism: A systematic review. Vol. 3, Journal of Thrombosis and Haemostasis. J Thromb Haemost; 2005. p. 2465–70.
- Gupta RT, Kakarla RK, Kirshenbaum KJ, Tapson VF. D-dimers and efficacy of clinical risk estimation algorithms: Sensitivity in evaluation of acute pulmonary embolism. American Journal of Roentgenology. 2009 Aug;193(2):425–30.
- Warren D, Matthews S. Pulmonary embolism: Investigation of the clinically assessed intermediate risk subgroup. British Journal of Radiology. 2012 Jan;85(1009):37–43.
- Stein PD, Hull RD, Patel KC, Olson RE, Ghali WA, Brant R, et al. D-Dimer for the Exclusion of Acute Venous Thrombosis and Pulmonary Embolism: A Systematic Review. Vol. 140, Annals of Internal Medicine. American College of Physicians; 2004.
- Righini M, Van Es J, Den Exter PL, Roy PM, Verschuren F, Ghuysen A, et al. Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism: The ADJUST-PE study. JAMA – Journal of the American Medical Association. 2014 Mar 19;311(11):1117–24.
- Konstantinides S V., Meyer G, Bueno H, Galié N, Gibbs JSR, Ageno W, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European respiratory society (ERS). Vol. 41, European Heart Journal. Oxford University Press; 2020. p. 543–603.
- Kearon C, de Wit K, Parpia S, Schulman S, Afilalo M, Hirsch A, et al. Diagnosis of Pulmonary Embolism with d -Dimer Adjusted to Clinical Probability . New England Journal of Medicine. 2019 Nov 28;381(22):2125–34.
- Stein PD, Woodard PK, Weg JG, Wakefield TW, Tapson VF, Sostman HD, et al. Diagnostic pathways in acute pulmonary embolism: Recommendations of the PIOPED II – Investigators. Vol. 242, Radiology. Radiology; 2007. p. 15–21.
- Cook j. V, Kyriou J. Radiation from CT and perfusion scanning in pregnancy. BMJ. 2005 Aug 6;331(7512):350.
- Webb JAW, Thomsen HS, Morcos SK, Almén T, Aspelin P, Bellin MF, et al. The use of iodinated and gadolinium contrast media during pregnancy and lactation. European Radiology. 2005;15(6):1234–40.
- Bourjeily G, Chalhoub M, Phornphutkul C, Alleyne TC, Woodfield CA, Chen KK. Neonatal thyroid function: Effect of a single exposure to iodinated contrast medium in utero. Radiology. 2010 Sep;256(3):744–50.
- Moores LK, Jackson WL, Shorr AF, Jackson JL. Meta-analysis: Outcomes in patients with suspected pulmonary embolism managed with computed tomographic pulmonary angiography. Vol. 141, Annals of Internal Medicine. American College of Physicians; 2004. p. 866–74.
- Le Gal G, Kovacs MJ, Carrier M, Do K, Kahn SR, Wells PS, et al. Validation of a diagnostic approach to exclude recurrent venous thromboembolism. Journal of Thrombosis and Haemostasis. 2009;7(5):752–9.
- Gillet JL, Perrin MR, Allaert FA. Short-term and mid-term outcome of isolated symptomatic muscular calf vein thrombosis. Journal of Vascular Surgery. 2007 Sep;46(3):513–9.
- Ferrara F, Meli F, Amato C, Cospite V, Raimondi F, Novo G, et al. Optimal duration of treatment in surgical patients with calf venous thrombosis involving one or more veins. Angiology. 2006 Aug;57(4):418–23.
- Siragusa S, Malato A, Anastasio R, Cigna V, Milio G, Amato C, et al. Residual vein thrombosis to establish duration of anticoagulation after a first episode of deep vein thrombosis: The Duration of Anticoagulation based on Compression Ultrasonography (DACUS) study. Blood. 2008 Aug 1;112(3):511–5.
- Prandoni P, Prins MH, Lensing AWA, Ghirarduzzi A, Ageno W, Imberti D, et al. Residual thrombosis on ultrasonography to guide the duration of anticoagulation in patients with deep venous thrombosis, A randomized trial. Annals of Internal Medicine. 2009 May 5;150(9):577–85.
- Cosmi B, Legnani C, Cini M, Guazzaloca G, Palareti G. D-dimer and residual vein obstruction as risk factors for recurrence during and after anticoagulation withdrawal in patients with a first episode of provoked deep-vein thrombosis. Thrombosis and Haemostasis. 2011 May;105(5):837–45.
- Cosmi B, Legnani C, Iorio A, Pengo V, Ghirarduzzi A, Testa S, et al. Residual Venous Obstruction, alone and in Combination with D-Dimer, as a Risk Factor for Recurrence after Anticoagulation Withdrawal following a First Idiopathic Deep Vein Thrombosis in the Prolong Study. European Journal of Vascular and Endovascular Surgery. 2010 Mar;39(3):356–65.
- Donadini MP, Ageno W, Antonucci E, Cosmi B, Kovacs MJ, Le Gal G, et al. Prognostic significance of residual venous obstruction in patients with treated unprovoked deep vein thrombosis: A patient-level meta-analysis. Vol. 111, Thrombosis and Haemostasis. Schattauer GmbH; 2014. p. 172–9.
- Le Gal G, Kovacs MJ, Carrier M, Do K, Kahn SR, Wells PS, et al. Validation of a diagnostic approach to exclude recurrent venous thromboembolism. Journal of Thrombosis and Haemostasis. 2009;7(5):752–9.
- Hamadah A, Alwasaidi T, Le Gal G, Carrier M, Wells PS, Scarvelis D, et al. Baseline imaging after therapy for unprovoked venous thromboembolism: A randomized controlled comparison of baseline imaging for diagnosis of suspected recurrence. Journal of Thrombosis and Haemostasis. 2011 Dec;9(12):2406–10.
- Nijkeuter M, Hovens MMC, Davidson BL, Huisman M V. Resolution of thromboemboli in patients with acute pulmonary embolism: A systematic review. Chest. 2006;129(1):192–7.
- Safai Zadeh E, Dietrich CF, Kmoth L, Trenker C, Alhyari A, Ludwig M, et al. Peripheral Pulmonary Lesions in Confirmed Pulmonary Arterial Embolism: Follow-up Study of B-Mode Ultrasound and of Perfusion Patterns Using Contrast-Enhanced Ultrasound (CEUS). Journal of Ultrasound in Medicine. 2022 Jul 1;41(7):1713–21.
- Nazerian P, Gigli C, Reissig A, Pivetta E, Vanni S, Fraccalini T, et al. Retrospective analysis of the diagnostic accuracy of lung ultrasound for pulmonary embolism in patients with and without pleuritic chest pain. Ultrasound Journal. 2022 Dec 1;14(1).
Poslední aktualizace dne 16.09.2021
